一氧化碳的物理和化学性质
一氧化碳介绍:
一氧化碳(carbon monoxide),一种碳氧化合物,化学式为CO,化学式量为28.0101,通常状况下为是无色、无臭、无味的气体。物理性质上,一氧化碳的熔点为-205℃,沸点为-191.5℃,难溶于水(20℃时在水中的溶解度为0.002838 g ),不易液化和固化。化学性质上,一氧化碳既有还原性,又有氧化性,能发生氧化反应(燃烧反应)、歧化反应等;同时具有毒性,较高浓度时能使人出现不同程度中毒症状,危害人体的脑、心、肝、肾、肺及其他组织,甚至电击样死亡,人吸入最低致死浓度为5000 ppm(5分钟)。工业上,一氧化碳是一碳化学的基础,可由焦炭氧气法等方法制得,主要用于生产甲醇和光气以及有机合成等。
物理性质:
1、性状:无色、无臭、无味、难溶于水。
2、熔点(℃):-205
3、三相点(℃):-205.1(15.3 kPa)
4、沸点(101.325 kPa,℃): -191.5
5、相对密度(液态,水=1) : 0.793
6、相对蒸气密度(空气=1) : 0.967
7、比容(21.1℃,101.325 kPa,m3/kg) : 0.8615
8、蒸气压:20(-203.43℃,kPa),305(-180℃,kPa),3500(140℃,kPa)
9、临界温度(℃):-140.2
10、临界压力(kPa):3499
11、临界密度(kg/m3):301
12、辛醇/水分配系数 :1.78
13、黏度(101.325kPa,0℃,mPa·s):0.01662
14、表面张力(-100℃,N/m):0.0098
15、在空气中可燃范围(20℃,101.325kPa):12.5%~74%
16、在空气中的最低燃点(101.325kPa,℃):630
化学性质:
一氧化碳分子是不饱和的亚稳态分子,在化学上就分解而言是稳定的。常温下,一氧化碳不与酸、碱等反应,但与空气混合能形成爆炸性混合物,遇明火、高温能引起燃烧、爆炸,属于易燃、易爆气体。因一氧化碳分子中碳元素的化合价是+2,能被氧化成+4价,具有还原性;且能被还原为低价态,具有氧化性。
1.氧化反应(燃烧反应)
一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳: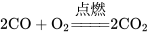 ,燃烧时发出蓝色的火焰,放出大量的热。
,燃烧时发出蓝色的火焰,放出大量的热。
2.歧化反应(分解反应)
由于一氧化碳分子中碳氧键很牢固,需要有很高的活化能,故一氧化碳实际上不能进行无催化分解。当一氧化碳活性吸附在某些物质的晶体表面上时,才有可能进行分解。这些物质中以铁居首位,有铁参与的一氧化碳分解机理可以表示为:
 总的化学反应方程式为:
总的化学反应方程式为: 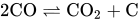 。
。
3.变换反应
在一定条件下,一氧化碳和水蒸气等摩尔反应生成氢气和二氧化碳:CO + H2O → H2+ CO2。在工业装置中,早期的一氧化碳变换反应通常分两段进行,即高(中)温变换和低温变换。高(中)温变换用铁系作催化剂,典型水蒸汽和一氧化碳比为3左右,在温度为300~500℃、空速为2000~4000 h-1的条件下,高温变换炉出口一氧化碳含量为2%~5%;低温变换用高活性铜锌催化剂,在温度为180~280℃、空速为2000~4000 h-1的条件下,低温变换炉出口一氧化碳含量为0.2%~0.5% 。
4.加氢反应
在不同的反应条件和催化剂作用下,一氧化碳加氢可合成多种有机物,如:合成甲醇、费托(Fischer-Tropsch)法合成烃(费托合成)、合成甲烷(甲烷化反应)、合成乙二醇、合成聚亚甲基(polymethylene)等。
(1)合成甲醇
选用铜-锌-铬催化剂,在温度为230~270℃、压力为5~10MPa、空速为20000-60000 h-1的条件下,一氧化碳和氢气反应生成甲醇:CO + 2H2→CH3OH。(2)费托合成
一氧化碳和氢气的混合气体在催化剂(如铁钴催化剂)和适当条件(温度为190~350℃、压力为0.7~20 MPa)下可以反应生成液态的烃或碳氢化合物(hydrocarbon)。 这一反应为非均相反应,反应产物是以直链烷烃和烯烃为主的混合物,可用以下反应通式表示: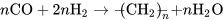 或
或 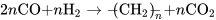 。
。
(3)甲烷化反应
以镍作催化剂,在温度为230~450℃、压力为0.1~10 MPa、空速为500-25000 h-1的条件下,氢气与一氧化碳之比不小于3时,可反应生成甲烷:CO + 3H2→CH4+H2O。这一反应为多相催化的气相反应,是费托合成的特例。
(4)合成乙二醇
以羰基铑络合物作催化剂,在温度为150~300℃和极高压力(约300 MPa)下,氢气与一氧化碳(氢气与一氧化碳之比接近1)转化为多元醇的选择性为60%~70%。其中,以乙二醇(HOCH2CH2OH)为主:2CO + 3H2→HOCH2CH2OH。反应在液相溶液中进行,副产物有丙二醇、丙三醇、甲醇、乙酸甲酯以及少量的高级醇等。(5)合成聚亚甲基
以金属钌作催化剂,一氧化碳和氢气在有利于甲烯(CH2)合成的压力(100~200 MPa)和温度(100~120℃)下,一氧化碳大部分与氢气反应生成聚亚甲基〔n(CH2)〕: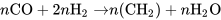 。由于反应条件苛刻、生成聚亚甲基的选择性低、时空产率不高等,此反应尚处于实验阶段。
。由于反应条件苛刻、生成聚亚甲基的选择性低、时空产率不高等,此反应尚处于实验阶段。
5.配位反应
一氧化碳可以和大部分过渡金属反应而生成羰络金属及其衍生物。
如在常温、常压下,一氧化碳可直接与活性金属镍粉反应而生成无色液体四羰基合镍〔Ni(CO)4〕: 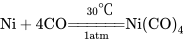 ;在200℃、200个大气压下,一氧化碳可与铁粉生成五羰基铁〔Fe(CO)5〕:
;在200℃、200个大气压下,一氧化碳可与铁粉生成五羰基铁〔Fe(CO)5〕: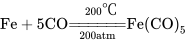 ;在更苛刻的条件下,一氧化碳能直接与钴、铑、钉、钼、钨反应,但产率低,没有实用价值。需要注意的是:金属的羰基化合物是易挥发的有毒固体或液体,且加热时立即分解成相应的金属和一氧化碳。(可据此提纯金属和制得纯一氧化碳)
;在更苛刻的条件下,一氧化碳能直接与钴、铑、钉、钼、钨反应,但产率低,没有实用价值。需要注意的是:金属的羰基化合物是易挥发的有毒固体或液体,且加热时立即分解成相应的金属和一氧化碳。(可据此提纯金属和制得纯一氧化碳)
6.与有机物反应
(1)与醇反应
①甲醇催化羰基化:一氧化碳与醇反应可以制羧酸,如甲醇催化羰基化制乙酸:CO+CH3OH→CH3COOH。采用不同催化剂,反应条件不相同:巴斯夫(BASF)工艺用碘改性的钴催化剂,相应的反应温度为250℃、压力为68 MPa,乙酸的选择性以甲醇计算为90%,以一氧化碳计算为70%;孟山都(Monsanto)工艺用铑-碘催化剂(Rh/I2),相应的反应温度为150~250℃、压力为1~4 MPa,乙酸的选择性以甲醇计算为99%,以一氧化碳计算为90%。
②强碱催化羰基化:以强碱(NaOH)催化,在温度为170~190℃、压力为1~2 MPa的条件下,一氧化碳与甲醇反应生成甲酸甲酯:CO + CH3OH → HCOOCH3。
③氧化羰基化:在温度为90℃、压力约为10 MPa、有氧参反应与时,一氧化碳可以和甲醇反应生成碳酸二甲酯或草酸二甲酯:2CO + 4CH3OH+ O2→ 2(CH3O)2CO + 2H2O或4CO + 4CH3OH+ O2→ 2CH3O-CO-CO-OCH3 + 2H2O。若选用氯化亚铜催化剂,则生成碳酸酯;若选用氯化钯和氯化铜的混合物作催化剂,则生成草酸酯。
④醇的同系化反应:一氧化碳和醇在有氢气存在的情况下反应而生成高一级的醇。如以羰基钴作催化剂,在温度为200℃、压力为30 MPa的条件下,一氧化碳和甲醇、氢气反应生成乙醇:CO + CH3OH+ 2H2→ CH3CH2OH + H2O。
(2)与不饱和烃反应羰基
①雷佩(Reppe)反应(氢羧基化反应):一氧化碳与不饱和烃、水的羰基化反应。如以钴或铑作催化剂,在温度为175~195℃、压力为3~7 MPa的条件下,一氧化碳与乙烯、水反应生成丙酸:CO + H2C=CH2 +H2O → CH3CH2COOH。
②氢酯基化反应:一氧化碳与不饱和烃、醇的羰基化反应。如以羰络镍作催化剂,一氧化碳与乙炔、甲醇可以在接近常温常压的条件下反应生成丙烯酸甲酯:CO + HC≡CH+ CH3OH → H2C=CHCOOCH3。
③氧化羰基化:一氧化碳与不饱和烃、氧气反应生成羧酸或酯。如以氯化钯或氯化铑作催化剂,在温度为110℃、压力为10 MPa的条件下,一氧化碳与乙烯、氧气反应生成丙烯酸:2CO + 2H2C=CH2+O2→ 2H2C=CH-COOH。
(3)其他反应
除了与醇和不饱和烃反应外,一氧化碳还可以与醛、醚、酯、胺、卤代烃、芳香烃及其衍生物反应。如:
①以氢氟酸作催化剂,在温度为常温、压力为7 MPa的条件下,一氧化碳与甲醛、水反应生成乙醇酸:CO + HCHO+ H2O→ HOCH2COOH。
②同系化反应:以钯和铑的碘化物作催化剂,在温度为135~160℃、压力为30 MPa的条件下,一氧化碳和氢气的混合气体与乙酸甲酯反应而生成亚乙基二乙酸酯:2CO + 2CH3COOCH3+ H2→ CH3CH(OOCCH3)2 +CH3COOH。
③以甲醇钠作催化剂,在温度为60~130℃、压力为0.5~0.9 MPa的条件下,一氧化碳与二甲胺在溶液中反应生成二甲基甲酰胺(DMF):CO + (CH3)2NH→ (CH3)2NCHO。
④加特曼-科赫反应:在氯化亚铜和氯化铝的作用下,芳香烃可与一氧化碳和干燥的氯化氢反应而生成相应的芳香甲醛。如苯可与一氧化碳和干燥的氯化氢反应而生成苯甲醛:Ph + CO +HCl → Ph-CHO + HCl。(Ph表示苯基)
7.与金属氧化物反应
高温下,一氧化碳能将许多金属氧化物还原成金属单质,如:
①将黑色的氧化铜还原成红色的金属铜: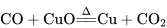 ;
;
②将氧化锌还原成金属锌: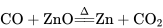 ;
;
③在炼铁炉中可发生多步还原反应:
总的化学反应方程式为:  。
。
8.与五氧化二碘
在65~70℃间,一氧化碳能与五氧化二碘(I2O5)反应生成碘单质(I2):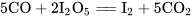 。(可据此定量鉴定一氧化碳)
。(可据此定量鉴定一氧化碳)
9.与氯气反应
以活性炭作催化剂,在正压力和500 K温度下,等摩尔的一氧化碳和氯气混合,可以反应生成碳酰氯(俗称“光气”):  。
。
10.与氯化钯反应
常温下,一氧化碳可以将氯化钯溶液中氯化钯(PdCl2)的还原成金属钯: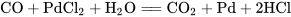 。(常用来检测一氧化碳的存在)
。(常用来检测一氧化碳的存在)

